
Inteligencia Artificial aplicada al glaucoma
Uno de los objetivos clave en el glaucoma es identificar a las personas en riesgo de progresión rápida y ceguera. La inteligencia artificial y los algoritmos de aprendizaje automático se utilizan cada vez más en el cuidado de la salud, especialmente en la oftalmología, y se han convertido en ayudas analíticas importantes en las imágenes de la retina.
La inteligencia artificial (IA) se ha ido incorporando poco a poco en nuestra vida con el uso de distintos dispositivos y softwares que usamos a diario. En términos generales, la lA consiste en la realización de una tarea, principalmente llevada a cabo por una computadora o un robot, con una participación mínima de seres humanos, que puede imitar funciones cognitivas como el aprendizaje y la resolución de problemas.
Dentro de este campo encontramos un subtipo de lA denominado “aprendizaje automático” (también llamado machine learning) que utiliza múltiples capas de redes neuronales convolucionales (CNN). Una CNN es un tipo de red neuronal artificial con aprendizaje supervisado que procesa sus capas imitando a la corteza visual del ser humano, para identificar distintas características en las entradas que en definitiva
hacen que pueda identificar objetos y “ver”. Para que esto sea posible, la red neuronal necesita contar con una gran cantidad de imágenes que formen parte de su base de datos.
Entonces, los sistemas de lA se pueden entrenar para realizar tareas mediante el procesamiento de grandes cantidades de datos y reconocimiento de patrones, e incluso predecir el curso de distintos eventos a partir de distintas bases de datos.
“EN EL CAMPO DE LA OFTALMOLOGÍA, EL USO DE lA RESULTA MUY ADECUADO Y HA DEMOSTRADO TENER UN ENORME POTENCIAL. ESTO ES IMPORTANTE PARTICULARMENTE EN EL GLAUCOMA, UNA DE LAS PRINCIPALES CAUSAS DE CEGUERA IRREVERSIBLE, DONDE LA DETECCIÓN Y EL TRATAMIENTO TEMPRANOS SON HERRAMIENTAS FUNDAMENTALES PARA PRESERVAR LA VISIÓN DE LAS PERSONAS AFECTADAS POR ESTA PATOLOGÍA”. 1
Numerosos estudios demostraron que la lA puede contribuir en la detección, diagnóstico, progresión y tratamiento de la enfermedad a través de algoritmos que procesan una gran cantidad de información obtenida por medio de imágenes de fondo de ojo, tomografías de coherencia óptica y evaluaciones de campo visual (Figura 1).2
Para fotografías de fondo de ojo, Li et al. evaluaron un algoritmo que mostró una alta sensibilidad (95,6 %) y especificidad (92 %) para detectar neuropatía óptica glaucomatosa.3 Como desventaja, se observó que la miopía elevada provocaba falsos negativos y la excavación de papila fisiológica provocaban falsos positivos.
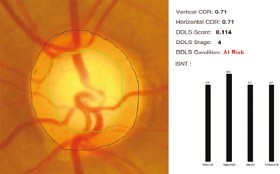
Figura 1. Imagen de una fotografía de fondo de ojo en la que se segmentan los márgenes del disco óptico y la copa. A la derecha, se muestran la relación copafdisco vertical, la relación copafdisco horizontal y la probabilidad de daño del disco junto con el gráfico correspondiente al borde neurorretiniano inferior, superior, nasal y temporal. (Imagen cortesía de: Leben Care Technologies Pte., Ltd.)
La aplicación de la lA también sería de gran utilidad para simplificar la interpretación los campos visuales. En otro estudio, Li et al. evaluaron una CNN para diferenciar automáticamente el campo visual de un paciente con glaucoma del CV de uno sin glaucoma.4 Wen et al. entrenaron un sistema de lA con 32.443 campos visuales tomados entre 1998 y 2018, y el modelo CascadeNet-5 resultante pudo predecir campos visuales futuros por hasta 5,5 años en función de un solo campo visual de entrada.5 Kazemian et al. desarrollaron y validaron los filtros de Kalman, que podían predecir la progresión de la desviación media de los campos visuales con diferentes PIO target de forma personalizada.6 Esto representaría una herramienta adicional para guiar a los oftalmólogos en la elección de la PIO target específica para un paciente.
Otro ejemplo de la aplicación de lA en glaucoma son pruebas diagnósticas como la llamada DARC (detección de células retinianas en apoptosis). La misma consiste en administrar por vía endovenosa un marcador fluorescente (Anexina V marcada con fluorescencia) que tiene la capacidad de unirse a la fosfatidilserina expuesta en las membranas apoptóticas. De esta forma, las células que están en apoptosis aparecen como “puntos blancos brillantes” en la retina (Figura 2).
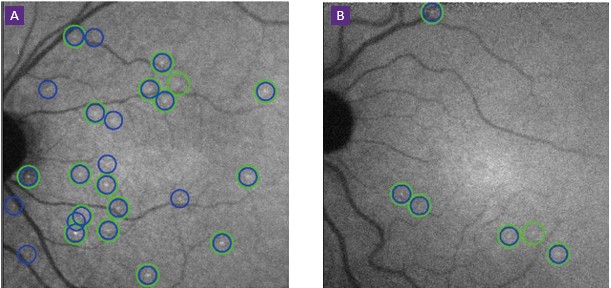
Figura 2. Comparación representativa de los puntos DARC detectados por el observador y por el algoritmo de la CNN. Se muestran los puntos encontrados por la CNN y puntos encontrados por al menos 2 observadores manuales en una imagen retinal original. (A) Paciente con glaucoma progresivo. (B) Paciente con glaucoma estable. Círculos verdes: solo observadores manuales (falso negativo); Círculos azules: solo algoritmo asistido por CNN (falso positivo); Círculos mixtos: el algoritmo y los observadores manuales están de acuerdo (verdadero positivo).
En un estudio publicado recientemente, se analizó la combinación del método DARC con un algoritmo asistido por una CNN para predecir la progresión del glaucoma.7 Los resultados obtenidos en este estudio demostraron que el mayor recuento de puntos DARC se asoció con un adelgazamiento significativo del espesor de la capa de las fibras nerviosas de la retina de todos los pacientes incluidos en el estudio a los 18 meses, con una elevada sensibilidad y especificidad. Estos resultados son muy prometedores, ya que muestran que el método DARC podría usarse como un biomarcador cuando se combina con el algoritmo asistido por lA para predecir con éxito el progreso de la enfermedad glaucomatosa.
Si bien hoy aún no está listo un sistema de IA que integre toda esta información que incluye lasmediciones de la presión intraocular, la copa del disco óptico, los campos visuales, la gonioscopía y la tomografía de coherencia óptica, no quedan dudas de que veremos muchas más innovaciones en este campo de rápido crecimiento, que representa una promesa real para combatir la enfermedad, avanzar en la medicina personalizada y mejorar la salud visual de cada paciente.
Referencias: 1) Mayro EL, Wang M, Elze T, Pasquale LR. The impact of artificial intelligence in the diagnosis and management of glaucoma. Eye. 2020:34(1):1-11. 2) Akkara J. Kuriakose A. Role of artificial Intelligence and machine learning in ophthalmology. Kerala ] Ophthalmol. 2019;31(2):150. 3) LI Z, He Y, Keel S, Meng W, Chang RT, He M. Efficacy of a Deep Learning System for Detecting Glaucomatous Optic Neuropathy Based on Color Fundus Photographs. Ophthalmology. 2018:125(8):1199-206.4) LJ F, Wang Z, Qu G, Sang D, Yuan Y, Xu Y, et al. Automatic differentiation of Glaucoma visual field from non-glauco- ma visual filed using deep convolutional neural network. BMC Med Imaging. 2018; 18(1):1-7. 5) Wen JC, Lee CS, Keane PA, Xiae S., Rokem AS, Chen PP, et al. Forecasting future humphrey visual fields using deep learning. PLoS One. 2019;14(4):1-14. 6) Kazemian P. Lavieri MS, Van Oyen MP, Andrews C, Stein JD. Personalized Prediction of Glaucoma Progression Under Different Target Intraocular Pressure Levels Using Filtered Forecasting Methods. Ophthalmology. 2018, 125(4):569-77. 7) Normando EM, Yap TE, Maddison J, Miodragovic 5, Bonetti P, Almonte M, et al. A CNN-aided method to predict glaucoma progression using DARC (Detection of Apoptosing Retinal Cells). Expert Rev Mol Diagn. 2020;20(7):737-48




